核酸适配体(aptamer)由诺奖获得者Jack Szostak命名,是一类短的、单链DNA(ssDNA)或RNA寡核苷酸,通过形成三维空间结构,结合特定蛋白或者细胞发挥作用。基于其独特的生物学和化学特性,核酸适配体正在用于诊断试剂和治疗药物的开发。指数富集的配体系统进化技术(SELEX)是核酸适配体筛选的金标准方法,主要基于核酸文库与目标蛋白或细胞在溶液中或者在细胞表面的亲和力作用,再结合深度测序捕获富集序列。与此同时,对CRISPR/Cas的改造,已经拓展出远远超过其天然核酸酶的功能,发展出了转录调控、表观遗传调控、基因组标记等丰富多彩的应用。
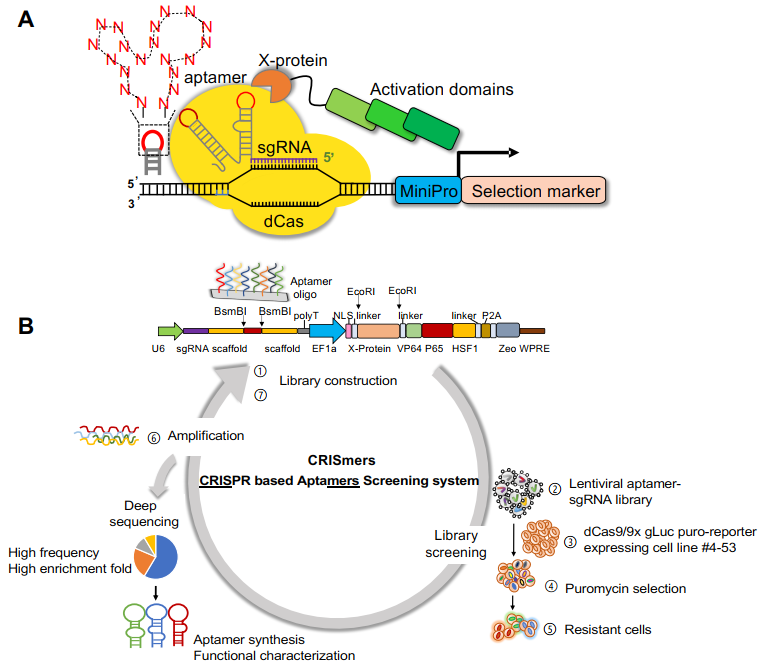
近日,深圳大学生命与海洋科学学院王宇课题组,联合广州实验室赵金存教授,清华大学谭旭研究员,中国科学院动物研究所周兵研究员以及深圳疾控中心张仁利教授,在Advanced Science(IF=17.5)上发表了题目为Repurposing CRISPR/Cas to Discover SARS-CoV-2Detecting and Neutralizing Aptamers的文章,报道了一种新颖的基于CRISPR/Cas的RNA配体筛选系统:CRISmers(CRISPR based aptamersscreening system)。有别于传统的SELEX筛选,CRISmers将RNA适配体筛选从溶液体系或者细胞表面搬到了细胞内,从而提供了胞内天然生物环境下的RNA和蛋白质的折叠与相互作用,并避免了筛选过程中的环境波动影响。CRISmers通过CRISPR/Cas的转录激活功能,将RNA适配体与靶蛋白的亲和作用转化为抗生素筛选压力下细胞的存活能力,以每个单细胞作为相互隔离的物理单元,区分功能性事件和背景噪音。

首先,该团队设想了CRISmers的概念,然后应用GFP和此前经SELEX筛选获得的RNA适配体进行了初步的概念验证和筛选系统的关键参数指征,从而得到了CRISmers筛选系统的工作流程。简单来说,将适配体随机序列文库以pooled方式构入进sgRNA骨架,若文库中含有与特定靶蛋白结合的亲和序列,即可招募与靶蛋白融合的转录激活因子,从而激活下游抗性基因的表达。通过施加抗性筛选压力,即可将携带亲和配体的细胞在体系中富集。包含RNA适配体的文库通过慢病毒递送,整合进入细胞基因组。RNA适配体的序列信息可以通过提取基因组、定向扩增配体区段、以及深度测序获取。
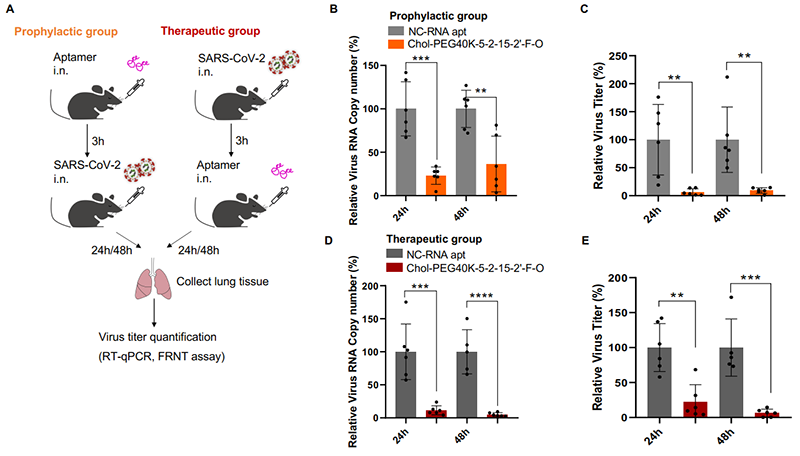
CRISmers理论上具有广泛的靶向性,但考虑到研究进行期间正值新冠疫情,该团队将第一个靶标指向了SARS-CoV-2刺突蛋白受体结构域RBD。通过初级筛选和二级验证,获得了可特异靶向RBD的2个优选的RNA适配体,且在体外呈现出有效的病毒检测和中和活性。有趣的是,和其他论文中报道的一致,核酸配体表现出不受病毒突变影响的现象,具有广谱抗SARS-CoV-2的潜力。这一现象也许和核酸配体内在的柔性结构特性有关。类似的,不同的CRISPR/Cas系统的向导RNA也观察到可以互换的现象。进一步,选取其中一条RNA适配体,团队发现,结合多种修饰和偶联,包括2’-氟嘧啶和2’-甲氧基RNA修饰(提升RNA稳定性),以及5’端胆固醇(呈递到呼吸道上皮细胞表面)和分子量为40kDa的聚乙二醇(延长体内半衰期)的偶联,经滴鼻给药,在小鼠体内实现了对Omicron BA.2活病毒的预防型和治疗型抗病毒中和活性。通过对比实验,团队发现胆固醇和聚乙二醇的偶联对于动物体内的活性不可或缺,尽管它们对于细胞水平上的中和活性可有可无。
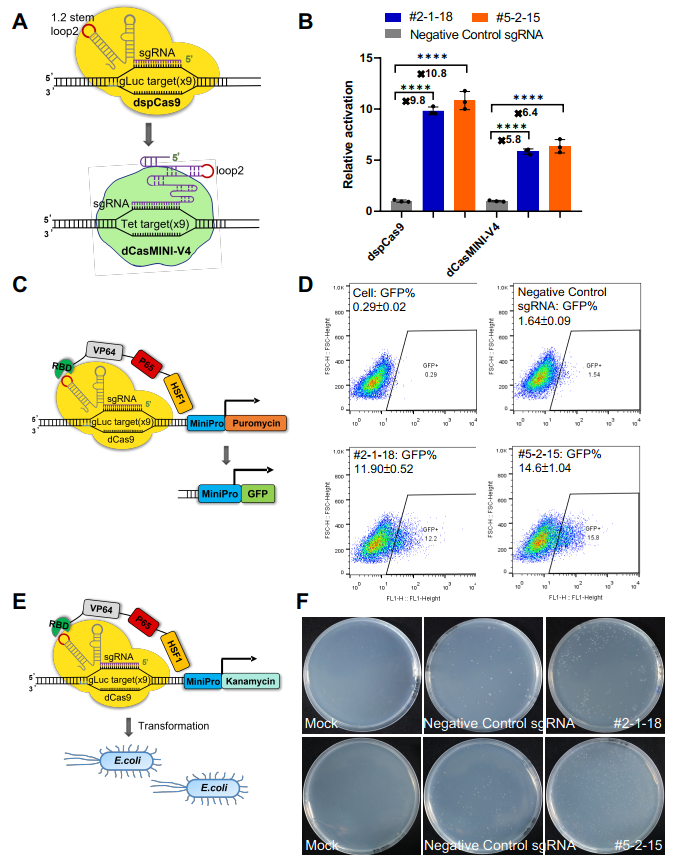
最后,该团队还对CRISmers系统的通用适配性进行了验证。应用靶向SARS-CoV-2 RBD筛选获得的两个RNA配体,对CRISmers系统中的元件分别进行了替换,包括(1)将dSpCas9替换成更小体积版本的dCasMINI-V4(2)将抗性基因替换成荧光蛋白;(3)将筛选宿主细胞由人HEK293T细胞系替换成大肠杆菌,均可捕获到RNA配体与RBD的亲和力信号。
近年来核酸药物的成功主要来自于以“信息分子”发挥作用的方式,包括siRNA, ASO, mRNA。与之对应的是,RNA作为“结构分子”虽然对于生物学的很多方面也非常重要(某种意义上,CRISPR/Cas中的向导RNA就是一个大aptamer!),但是以这样的角色转化为药物,虽然潜力巨大,但尚待发掘。CRISmers作为研究RNA作为“结构分子”的工具技术将可能发挥一定的作用。另外,CRISmers尽管看起来也适用于膜外的靶标,理论上而言对于膜内的靶标具有更加独特的价值。siRNA和mRNA等核酸药物跨过细胞膜对于实现它们的临床应用具有重要意义。随着核酸递送技术的进步,胞内靶点对于核酸药物而言也许将逐步获得和小分子化学药一样的可及性。因此,鉴于该论文的工作仅仅是CRISmers的第一个靶点,且位于病毒表面,该筛选系统尚待更多靶标和更长时间的检验。当下,基于上述成果,团队正在推进抗新冠病毒的候选鼻喷药物面向临床应用的开发工作。最新的测试显示,论文中报道的优选RNA适配体对于XBB.1.5和XBB.1.16假病毒保持活性。与此同时,面向后疫情时代,CRISmers正在被用于靶向癌症等疾病的研究。
中国科学院动物研究所博士生张菊和广州实验室博士后朱爱如为该论文的共同第一作者,王宇教授、赵金存教授、谭旭研究员、周兵研究员、张仁利教授为该论文共同通讯作者。
原文链接:https://doi.org/10.1002/advs.202300656
(生命与海洋科学学院 供稿)
